江苏吉泰肽业科技有限公司
联 系 人 :秦经理
座 机 :0515-84130555
手 机:17705109088
邮 箱:info@gtaipeptide.com
地 址:江苏省盐城市滨海县新安大道799号
网 址:www.gtaipeptide.com
邮 编:224500
一、前言
提起口服多肽,相信大家首先想到的肯定是近年来风头正劲的诺和诺德公司GLP-1类似物口服索马鲁肽。2019年绝对是口服索马鲁肽的丰收年,面对早已是一片红海的糖尿病领域,口服索马鲁肽在降糖、减重、保护心血管系统与肾脏等领域四面出击。在PIONEER 2和PIONEER 7两项与目前标准疗法的头对头临床实验中,口服索马鲁肽分别击败同为口服降糖制剂的礼来SGLT-2抑制剂(恩格列净,Jardiance)与默沙东DPP-4抑制剂(西格列汀,Januvia)。同时,在PIONEER 4中与自家前辈利拉鲁肽相比,口服索马鲁肽也在降糖方面获得了非劣性结果。此外,被礼来寄予厚望的GIP/GLP-1双靶点激动剂(Tirzepatide),虽然在一项6个月的2型糖尿病IIb期临床研究中展现了令业界乍舌的降糖与减重效果(高剂量组HbA1C降低2.4%、减重11.3公斤),但也伴随着高达32%的12周退组率。结合其它双靶点、三靶点激动剂不尽如人意的临床结果,礼来是否能为Tirzepatide找到最安全、最理想的治疗窗,目前看来还是个大大的问号。基于上述临床数据,刚刚上市的口服索马鲁肽看似已有在糖尿病领域统一六国之势,但在小编看来,口服索马鲁肽作为第一款真正意义上的口服大分子药物,将有可能对改变大分子药物治疗格局,历史地位不愧于其系列临床研究的名称PIONEER。
我们将在本篇内详细讨论口服多肽药物国际研发现状,主要分为口服多肽主要壁垒、口服多肽结构优化与口服多肽药物递送系统三大方面。由于篇幅有限,本文主题是多肽药物吸收,将重点介绍以促渗透剂为主的口服多肽给药系统,未来可就口服索马鲁肽临床实验设计与数据分析、大分子药物肠道吸收所涉及的解剖与生理知识、天然口服多肽的结构优化与经验借鉴等内容单独成文阐述,此处便不过度赘述。

二、口服多肽主要壁垒
口服抗体或多肽等大分子药物始,终是制剂研发领域的主要方向,尤其对于2型糖尿病等慢性疾病患者。由于,疾病早期阶段对患者生活质量影响较小,不同给药方式对患者生活的影响直接决定了依从性与药品销量。GLP-1赛道产品的不断更迭就是上述观点最经典的案例(Exenatide, bid/s.c. ➡ Liraglutide qd/s.c. ➡ Dulaglutide qw/s.c. ➡ Semaglutide qd/p.o.)。为此,诺和诺德、礼来等糖尿病领域巨头在上世纪末就已开始不遗余力的寻找有效的口服GLP-1解决方案了。但为什么经历了30余年的努力,目前仅有口服索马鲁肽成功上市哪?这就要从以下两方面来详细介绍一下多肽药物口服的主要壁垒所在了。
1、化学壁垒
人体消化系统分为消化道与消化腺,消化道主要包括口腔、食道、胃、十二指肠、空肠、回肠与结直肠,消化腺则主要指具有相关消化酶等分泌功能的腮腺、胰腺与肝脏。消化系统的主要生理功能是消化食物与吸收水、电解质及各类营养物质(糖、脂、蛋白质)。人体各项生理功能所需的能量消耗及组织合成代谢原料,均需通过对食物的消化与吸收供给。但在食物所提供的营养物质中,除维生素、水和无机盐可以被直接吸收利用外,蛋白质、脂肪和糖类等物质均不能被机体直接吸收利用,需在消化道内被分解为结构简单的小分子物质,才能通过肠粘膜屏障,被吸收进入血液和淋巴液。为了能够将摄入的食物充分消化,人体每日消化道分泌的消化液平均可达到9 L,主要包括强酸性的胃液与强碱性的肠液、胰液与胆汁,其中大部分可被末端回肠与结肠重吸收。如此大量、且具有强腐蚀性的消化液,足以将所有进入消化道的蛋白质均分解为单个氨基酸,但这对多肽、单克隆抗体等大分子药物则是灭顶之灾。

2、物理壁垒
除消化液对大分子药物的分解作用外,肠粘膜表面所覆盖的粘液层,以及肠粘膜细胞及细胞间紧密连接等构成的肠粘膜屏障,对于普通多肽及大分子药物都是不可能逾越的生理屏障。由粘蛋白与糖蛋白构成的粘液层,覆盖了全部胃肠道粘膜,为通过消化道的食糜起到润滑作用,同时可以有效地避免肠粘膜细胞与各类微生物及有毒物质接触,是人体与外界环境的一道重要屏障。各类粘蛋白与糖蛋白彼此间通过二硫键结合形成高度糖基化的大分子物质,从而有效避免被消化液內的各类蛋白酶水解。粘液层內分子间结构的孔洞大小、所带电荷、以及共价分子数量,均可直接影响多肽等大分子药物的通过性。由化学或生物合成的相关粘蛋白,可在体外模型中有效模拟粘液层的理化性质,已有大量实验模型可以对不同多肽分子穿透粘液层的能力进行早期评估。
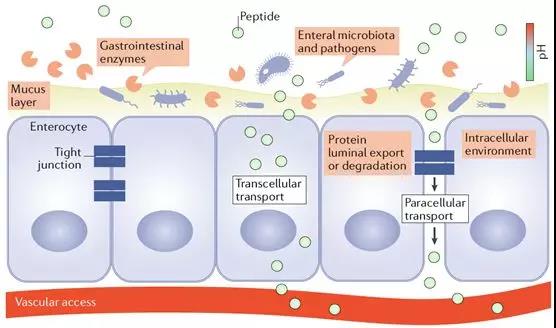
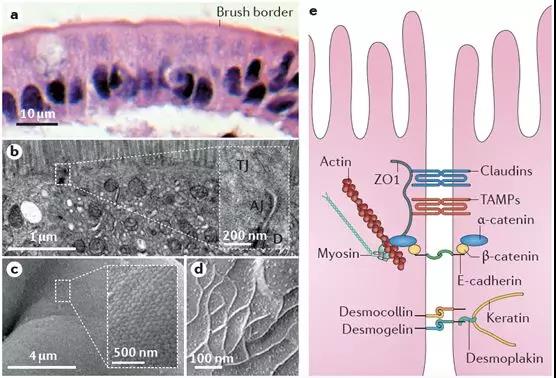
穿过粘液层后,即是肠粘膜上皮细胞的刷状缘了。从下图的病理与电镜图片中可以看到,肠粘膜上皮细胞以单细胞层形式紧密排列,细胞与细胞之间则由紧密连接结构进行封闭。任何通过肠道被吸收的物质,都只能通过肠粘膜上皮细胞或经细胞旁的紧密连接结构,吸收入粘膜下毛细血管或淋巴管网络。尽管肠粘膜细胞刷状缘细胞膜上分布着大量转运蛋白、离子通道等,既可以用来吸收肠腔内的水、电解质及营养物质,也可以向肠腔内分泌相关物质调节机体内稳态。但正如上文所述,无论是糖类、脂肪、还是蛋白质,都必须被分解为最基本形式的单糖、脂肪酸及氨基酸后,才可以穿过肠粘膜屏障被吸收。由紧密连接、粘附链接及细胞桥粒所封闭的细胞旁通路,在正常生理情况下,仅可以与肠腔内物质进行水和电解质的交换。此外,构成紧密连接等细胞旁通路的相关蛋白功能一旦受损,将造成严重腹泻等危险情况。
三、口服多肽结构优化
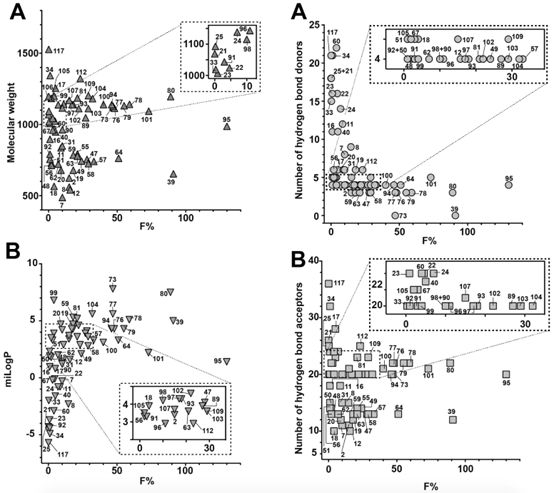
自Christopher Lipinski提出著名的“Rule of 5”(分子量小于500 Da、氢键供体少于5个、氢键受体少于10个、可旋转键少于10个、脂水分配系数对数值在-2至5之间)理论之后,小分子药物开发领域基本都严格遵循这一经典理论,但对于多肽及大分子生物药物来说,则完全不可能满足“Rule of 5”的所有要求。由于多肽分子普遍具有较高的极性、较大的极性表面积、大分子量、低脂溶性、高清除率、易降解等诸多缺点,口服多肽几乎是不可能实现的给药方式。然而,现实中也存在着特例,例如临床广泛使用的环孢素及去氨加压素这两个天然大环肽分子,却分别具有30%和0.17%的口服生物利用度。Daniel Nielsen等对125种具有不同口服生物利用度的天然环肽分子进行分析后总结到:对于环肽分子而言,分子量大小并不是影响生物利用度的主要原因;与氢键受体数量相比,氢键供体对生物利用度的影响更大;至于可旋转键问题,则可通过将肽链环化、增加分子刚性克服;而极性表面积在分析结果中并未体现出关键作用。此外,肽链的环化有助于内化分子中的氢键、极性分子、以及酶切位点,可以有效降低分子极性、减少极性表面积、增加脂溶性与分子刚性,有助于增加多肽分子对细胞膜的渗透性。
上文中已提到2019年10月Zealand Pharma为了口服大环肽相关技术,斥资8000万美元收购新型口服多肽公司Encycle Therapeutics(“三浪并发”关键时刻,展望新型多肽药物研发),可见口服大环肽改造已获得业界认可,而不是单纯限于实验室的早期技术。但此处小编需要强调,口服多肽与穿膜多肽之间还是存在较多差异,例如口服多肽更多强调抗消化液强酸强碱腐蚀与各类蛋白酶降解,由于可借助各类促渗透剂等药物递送系统增加生物利用度,只需同时兼具一定的细胞膜渗透性即可。与口服多肽不同,穿膜多肽的主要临床需求则是协助各类不能直接进入细胞内的药物穿透细胞膜,并作用于相关细胞内靶点。从临床需求出发,穿膜多肽的重点在于有效触达细胞内靶点,因此脂溶性、弱极性、减少分子内氢键、以及与linker及payload的稳定高效偶联等特性,才是穿膜多肽设计与优化的主要方向。

四、口服多肽药物递送系统
药物递送系统是本篇文章的主要重点,因为小编认为口服索马鲁肽之所以实现了口服大分子药物的突破,主要是因为促渗透剂辛酸钠(Salcaprozate Sodium, SNAC)与索马鲁肽的完美契合。作为GLP-1的长效类似物,索马鲁肽分子为传统线性肽,分子本身完全不具备任何口服生物利用度。SNAC通过非特异性的增加肠粘膜屏障通透性,使索马鲁肽可在短时间内穿透肠粘膜上皮细胞,从而被肠粘膜下毛细血管吸收入血。尽管与SNAC混合后,最终口服索马鲁肽制剂仅有约1%的口服生物利用度,但对于极度渴求减少注射次数的2型糖尿病患者来说,安全有效的口服制剂将大幅度提高生活质量。下文将分两大部分,分别介绍目前最主要的两类促渗透剂SNAC与癸酸钠(Sodium Caprate, C10)。目前,也有大量胰岛素微针注射器与肠道贴片等药物器械的临床研究,但考虑到制剂成本、治疗人群、消化道基础疾病等限制条件,显然促渗透剂才是当下口服多肽药物的主要选择,因此其它药物递送系统本文暂不做赘述。
1、促渗透剂(Permeation Enhancer, PE)
在口服大分子的众多体内及体外实验中,表面活性剂、胆汁酸盐、细菌毒素、螯合剂、中链脂肪酸等,都表现了不同程度的促渗透作用。目前为止,真正被应用于人体实验的促渗透剂只有SNAC、C10、中链脂肪酸、胆汁酸盐及八碳衍生物。C10的主要代表是Elan Pharma开发的GIPET口服固体制剂给药系统,随后将口服多肽技术授权给了Merrion Pharmaceuticals。现在众所周知的SNAC,则源自美国公司Emisphere开发的Eligen给药系统。诺和诺德早已明确了GLP-1赛道将向长效及口服发展,为此他们在上世纪九十年代就开始了各类口服胰岛素及口服GLP-1的探索,为此他们同时license in了GIPET和Eligen给药系统。经过充分的前期对比后,诺和诺德最终选择了具有高激动活性、长半衰期的索马鲁肽与SNAC制成口服片剂,自此开启了口服索马鲁肽的传奇之旅。

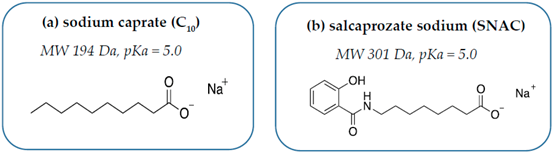
2、C10
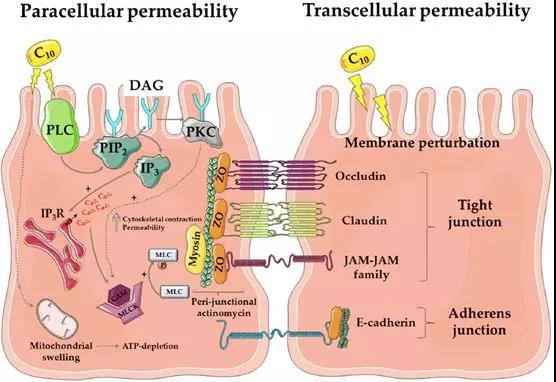
C10是癸酸钠,属于饱和中链脂肪酸,早已被美国及欧盟批注用作食物添加剂,并且是氨苄青霉素直肠栓剂(Doktacillin)的主要辅料之一。C10是一种对溶液pH值及离子强度敏感的阴离子表面活性剂,在胃部等强酸性环境下为不可溶的失活状态,在小肠等碱性环境下可激活其类去污剂活性。大量的体外实验已证实,C10在低浓度(2.5 mM)时主要通过可逆性干扰肠粘膜上皮细胞旁路增加大分子渗透性,在高浓度(8-13 mM)时则会直接影响肠粘膜结构与细胞旁通路。上文提及爱尔兰公司Merrion Pharma license inGIPET给药系统后,分别尝试结合胰岛素、去氨加压素、抗过敏寡核苷酸等大分子,并开展了相关临床研究,但结果不尽如人意。至今,除氨苄青霉素直肠栓剂外,尚无任何一款以C10作为递送系统的药物获批。
3、SNAC
SNAC是一种化学合成的水杨酸乙酰氨基酸衍生物,最早是由Emisphere公司在众多促渗透剂中筛选出来的高效分子。以SNAC作为主要辅料的口服维生素B12早先已被批准为医用食品上市,SNAC同时被FDA认定为食品安全物质(generally recognized assafe, GRAS)。与C10相同,可与API直接混合制成无包衣口服片剂,易于控制制剂生产成本及规模化。上世纪九十年代,Emisphere 公司曾进行多项以SNAC为主要辅料的口服肝素制剂临床实验,但始终未获得FDA批准,也导致了公司CEO及早期研发人员大量离职,并将SNAC转让给诺和诺德进一步开发。早期Emisphere研发团队认为SNAC通过非共价键形式与payload结合后,可使后者构型改变,暴露更多疏水区域,从而有利于增加细胞膜渗透性。在17 mg/mL浓度下,SNAC可有效提升胰岛素对Caco-2单细胞膜的渗透性,但激光共聚焦显微镜发现荧光标记甘露醇分子则仍然无法通过,这充分证明SNAC并不是通过开放紧密连接或破坏肠粘膜屏障完整性来提高胰岛素通过能力的。但目前为止,对于SNAC是否影响细胞旁路紧密连接结构仍未有定论。
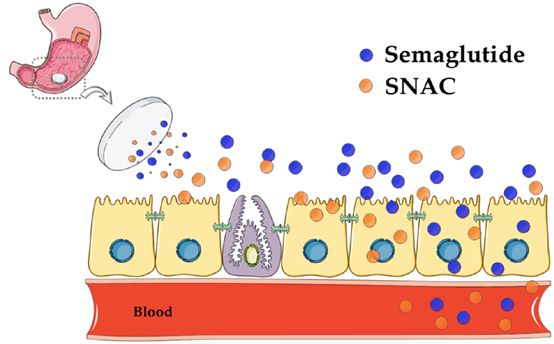
经过诺和诺德公司多年来的不懈努力,2019年9月20日FDA正式批准口服索拉鲁肽上市治疗2型糖尿病。与C10及大部分传统观点不同,诺和诺德公司在相关报告中表述口服制剂在胃内分级后,SNAC可有效增加索马鲁肽分子周围局部pH值,阻止胃蛋白酶对多肽的降解,并通过与肠粘膜上皮细胞刷状缘的接触,在细胞膜表面借助浓度梯度使索马鲁肽穿透胃黏膜后吸收入血。再次验证了SNAC对大分子生物利用度的提升,并不是通过对肠粘膜屏障的破坏而实现的。对于促渗透剂安全性的质疑一直存在,特别是肠道內不但有外界食糜带入的致病原,本身肠道内定植的大量微生物及相关产物,如果与药物大分子一同被吸收入血,将造成类似肠粘膜屏障破坏后菌群易位的严重并发症,可能引起生命危险。但无论是作为普通食品或医用食品添加剂,还是多年来各项以C10和SNAC为主的临床研究,都未曾有任何菌群易位的严重不良反应报道。如果我们来仔细计算一下,促渗透剂通常结合的payload大分子药物分子量均小于10 kDa,但细菌、病毒、以及细菌致病原脂多糖等分子量均大于100 kDa,可见对于促渗透剂引起肠道微生物或毒素进入体内的担忧确实有些杞人忧天了。
除了上述优势外,SNAC等促渗透剂当然存在诸多问题。首先,尽管口服索马鲁肽可以有效避免2型糖尿病患者常年的皮下注射,但在比较每周一次的皮下注射与每日口服的区别时,感受上的差距似乎已不是非常明显。况且,为了实现更好的生物利用度等目的,口服索马鲁肽要求禁食禁水6小时候方可服用,且服药后半小时不可进餐,这同样给患者带来了不适体验。此外,仅有约1%的生物利用度,也使得口服索马鲁肽片剂的原料药成本显著高于长效注射剂,这无疑将增加口服索马鲁肽制剂的终端售价。如果未来出现更长效的GLP-1制剂,相信广大2型糖尿病患者们可以做一道简单计算题,看看为了躲避皮下注射而花费的额外治疗费用是否值得。最后,还是要讨论一下安全问题,虽然SNAC等促渗透剂不会造成菌群易位等严重影响,但由于肠道內消化液pH值等环境条件变化巨大,促渗透剂对payload生物利用度的增加同样存在巨大波动。因此,只有像GLP-1类似物这类治疗剂量与危险剂量相差巨大的安全药物才适合采用促渗透剂方式给药,多肽药物治疗窗的大小将是评估其是否适合口服给药的关键点。
小编总结
口服多肽已明确成为多肽药物发展的未来趋势,尽管目前仅有口服索马鲁肽获批上市,但其对GLP-1赛道的颠覆效果已世人皆知。小编认为口服多肽固然优势巨大,但是否可以复制口服索马鲁肽的优异战绩还需要谨慎考虑。例如,从PK等数据角度分析,同样使用SNAC作为促渗透剂的口服索马鲁肽与未被批准的口服降钙素相差无几。然而,由于索马鲁肽拥有更长半衰期,以及更宽阔的治疗窗,为其安全有效的临床结果打下了坚实基础。显然SNAC并不是万能钥匙,我们需要更好的理解它的作用原理,从而为其找到理想的使用场景与合作伙伴(payload)。
